Авторитетность издания
Добавить в закладки
Следующий номер на сайте
Нейросетевая диагностика заболеваний сердечно-сосудистой системы на основе data-driven-метода
Аннотация:В работе рассмотрены способы диагностики заболеваний сердечно-сосудистой системы по электро-кардиограмме (ЭКГ) с применением методов искусственного интеллекта. Определены проблемы диагностики заболеваний сердечно-сосудистой системы модельно-ориентированными методами (model-driven methods). Предложен подход к диагностике методом машинного обучения без выделения характерных параметров ЭКГ-сигналов (data-driven method). Представлены архитектура нейроморфного анализатора ЭКГ-сигналов на основе одномерной сверточной нейронной сети и маршрут его проектирования. Проведены экспериментальные исследования на наборе ЭКГ-сигналов PTB-XL, подтвердившие работоспособность и эффективность предложенного подхода. Выполнены структурный и параметрический синтезы нейроморфного анализатора для разного количества внутренних слоев и исходных параметров обучения. В ходе сравнительного анализа полученных результатов установлено, что нейронная сеть с двумя сверточными слоями обладает низкой точностью обучения и высокими ошибками диагностирования, трехслойная нейронная сеть способствует росту ошибок I рода, а четырехслойная – росту ошибок II рода. Использование трехслойной сверточной нейронной сети с окном объединения меньшего размера обеспечило диагностирование до 85,66 % случаев инфаркта миокарда. В заключении означены направления дальнейших исследований по повышению точности диагностирования за счет снижения размерности входных ЭКГ-сигналов, а также введения вероятностной оценки принадлежности рассматриваемого сигнала одному из возможных состояний двойственной группы.
Abstract:The paper considers methods for diagnosing cardiovascular diseases by electrocardiogram (ECG) tracing using artificial intelligence methods. It also determines the problems of diagnosing cardiovascular diseases by model-driven methods. The author proposes an approach to diagnosing cardiovascular diseases by a data-driven machine learning method without extracting the characteristic parameters of ECG signals. There is a presented architecture of a neuromorphic ECG signal analyzer based on a one-dimensional convolutional neural network, as well as its design route. Experimental studies were carried out on a set of ECG signals PTB-XL; they confirmed the operability and efficiency of the proposed approach. Both structural and parametric synthesis of a neuromorphic analyzer was performed for a different number of internal layers and initial training parameters. A comparative analysis of the obtained results found that a neural network with two convolutional layers has low training accuracy and high diagnosis errors; a three-layer neural network contributes to the growth of type I error; a four-layer neural network contributes to the growth of type II error. The use of a three-layer convolutional neural network with a smaller pooling window provided the diagnosis of up to 85.66 % of myocardial infarction cases. In conclusion, the author gives the directions for further research to improve the diagnosis accuracy by reducing an input ECG signal dimension, as well as introducing a probabilistic assessment of whether the considered signal belongs to one of the possible states of an ambiguity group.
| Авторы: Мосин С.Г. (smosin@vpti.vladimir.ru) - Владимирский государственный университет им. Александра Григорьевича и Николая Григорьевича Столетовых, Владимир, Россия, кандидат технических наук | |
| Ключевые слова: нейросетевая диагностика, нейроморфный анализатор, ЭКГ-сигнал, диагностика заболеваний сердечно-сосудистой системы, архитектура нейроморфного анализатора, маршрут проектирования, data-driven метод |
|
| Keywords: NA design route, neuromorphic analyzer (NA), ECG signals, diagnostics of cardiovascular diseases, NA architecture, computer aided design, data-driven method |
|
| Количество просмотров: 167 |
Статья в формате PDF |
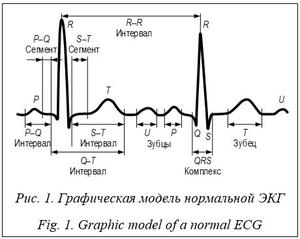
Введение. Методы машинного обучения находят широкое применение в различных областях деятельности человека, обеспечивая поддержку принятия решений на основе обработки больших объемов данных. Выделяют три основных направления использования методов: классификация (с учителем), кластеризация (без учителя) и регрессия. Методы классификации на основе машинного обучения получили широкое распространение в распознавании графических образов – объектов [1], рукописных символов [2], в тестировании и диагностике неисправностей технических объектов [3], диагностике заболеваний по результатам медицинских анализов и исследований [4, 5] и др. По оценке Всемирной организации здравоохранения, заболевания сердечно-сосудистой системы являются одной из главных причин летальных исходов и инвалидности человека. Ранняя диагностика этих заболеваний позво- ляет назначить эффективный способ профилактики и лечения, повышая продолжительность и качество жизни пациента.
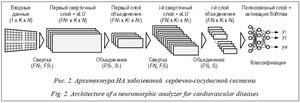
Так, в работе [6] предложено использовать многослойный персептрон для диагностики нормального состояния и четырех заболеваний сердечно-сосудистой системы на основе девяти характерных параметров ЭКГ-сигнала, которые подаются на входной слой. Для обучения использован алгоритм обратного распространения ошибки. Применение метода Гамильтона для обнаружения R-пиков ЭКГ-сиг- налов и последующая бинарная классификация с использованием методов машинного обучения – случайный лес, логистическая регрессия, метод опорных векторов и нейронная сеть – описаны в [7]. В работе [8] рассмотрена пред- обработка ЭКГ-сигналов с использованием КИХ-фильтра и сегментации с последующим обучением сверточной нейронной сети (НС) полученными отсчетами с применением алгоритма обратного распространения ошибки и алгоритма оптимизации Adam. Подход к выделению характерных параметров QRS-ком- плекса на основе сегментации ЭКГ-сигналов методом декомпозиции вариационного режима и усреднения сигнала с выпрямлением по фазе с последующей обработкой методами искусственного интеллекта (методом опорных векторов (SVM), ближайших средних (KNN), наивного байесовского классификатора (NB)) предложен в [9]. Система автоматического анализа ЭКГ с использованием метода детектирования ключевых точек и сегментации с после- дующей классификацией заболеваний сердечно-сосудистой системы методами машинного обучения представлена в [10]. Анализ показал, что наличие шумов и искажений в реальных сигналах ЭКГ требует специализированной предобработки, связанной с фильтрацией, сегментацией, спектральным разложением и прочим, что предполагает наличие дополнительных вычислительных средств и затрат времени. Выделенные в итоге из ЭКГ-сигнала характерные параметры используют для обучения нейроморфного классификатора. Критическими шагами на этапе обучения НС являются выбор количества используемых параметров и оценка степени их влияния на качество диагностики. Наличие в обучающем наборе характерных параметров с низким влиянием на различимость диагностируемых состояний, а также исключение из обучающих наборов характерных параметров с высокой степенью влияния на различимость могут приводить к снижению качества обучения НС и последующей диагностики. Альтернативой модельно-ориентированным методам, позволяющей избавиться от их недостатков и слабых сторон, могут служить методы машинного обучения, ориентированные на данные (data-driven methods). Главное требование таких методов – наличие большого объема размеченных данных, охватывающих разные варианты диагностируемых состояний. Методы глубокого машинного обучения (deep learning) и сверточные НС (Convolution Neural Network – CNN) нашли применение в данном направлении. Например, сверточная НС VGG16 и алгоритм обнаружения объектов YOLOv2 предложены в [11] для построения вектора признаков и распознавания лиц человека по видео. В [12] рассмотрены нейросетевая сверточная модель и этапы предобработки исходных данных для повышения точности диагностирования заболеваний дыхательных путей по анализу аудиозаписей дыхания пациентов. В [13] авторы предлагают применять архитектуру сверточной НС OpenPose, модифицированную моделью внимания, для автоматического выделения частей тела человека по изображению. Две модели глубокого машинного обучения для предсказания рубцов миокарда по сигналам ЭКГ и клиническим параметрам, где первая модель основана на сверточной НС, а вторая – на комбинации CNN и НС прямого распространения (Feedforward Neural Network – FNN), предложены в [14]. Результаты экспериментальных исследований показали среднюю точ- ность диагностики на уровне 70,2 % и 78,0 % для первой и второй моделей соответственно. В данной работе предложен подход к автоматизированному построению нейроморфного анализатора (НА), обеспечивающего диагностику заболеваний сердечно-сосудистой системы при обработке непосредственных сигналов ЭКГ data-driven-методом машинного обучения без явного выделения характерных параметров. Цель – автоматизация построения НА заболеваний сердечно-сосудистой системы на основе прямой классификации сигналов ЭКГ (без явного выделения характерных параметров) и его исследование. Научная новизна заключается в следующем: – предложена архитектура НА ЭКГ-сигна- лов, рассматриваемых в виде многомерных временных рядов, на основе одномерной сверточной НС, обеспечивающая диагностику заболеваний сердечно-сосудистой системы; – разработан маршрут проектирования НА ЭКГ-сигналов, включающий автоматизированный структурный и параметрический синтез по заданному множеству ограничений; – проведены экспериментальные исследования предложенного решения на наборе реальных данных пациентов, в ходе которых обеспечена эффективность диагностики инфаркта миокарда и предынфарктного состояния выше 85,6 %. Представление сигналов ЭКГ ЭКГ регистрирует сердечную активность с сохранением измеряемых электрических сигналов, нормальная форма которых имеет вид, представленный на рисунке 1. Запись ЭКГ в стандартных условиях проводят в двенадцати отведениях с подключением базового электрода (земля) к правой ноге пациента: – стандартные двухполюсные (I, II и III) фиксируют во фронтальной плоскости разность потенциалов между двумя точками электрического поля на разных конечностях пациента; – усиленные однополюсные (aVr, aVl и aVf) регистрируют разность потенциалов между одной из конечностей (r – правая рука, l – левая рука, f – левая нога), к которой подключен положительный электрод, и средним потенциалом с двух других конечностей (отрицательный электрод); – грудные отведения (v1–v6) регистрируют разность потенциалов между активным поло- жительным электродом, установленным в опре- деленную точку грудной клетки (6 вариантов), и отрицательным электродом на трех конечностях. Каждый зубец ЭКГ-сигнала отражает разные фазы сердечной активности: P – процесс возбуждения и расслабления предсердий; Q, S – фазу деполяризации межжелудочковой перегородки; R – фазу деполяризации нижних камер сердца; T – расслабление миокарда; U может отсутствовать, появление связывают с персистирующей электрической активностью отдельных элементов желудочков. Сигнал ЭКГ в каждом отведении можно рассматривать в виде временного ряда, представленного временными отсчетами {x(ti)} с заданной частотой дискретизации (fs), где ti = t0 + + i/fs, t0 – начальное время записи отсчетов, i = 1, ..., N, N – количество временных отсчетов. Сигналы в двенадцати отведениях можно представить многомерным временным рядом: TS ={xk(ti)}, k = 1, …, 12, i = 1, ..., N, (1) где Архитектура нейроморфного анализатора Реализацию НА предлагается осуществлять с использованием одномерной многослойной сверточной НС. В основе выбора архитектуры лежит анализ способа представления исходных данных (ЭКГ-сигналов) и ожидаемого результата в виде идентификатора принадлежности к одной из классификационных групп, соответствующей диагностируемому заболеванию. Использование сверточной НС обусловлено ее возможностями обработки непосредственных данных с выделением из них необходимых для классификации признаков в ходе операции свертки на этапе обучения. Одномерность сверточной НС определена структурой представления сигнала ЭКГ, как многомерного временного ряда (1), в виде прямоугольной матрицы X = [xki], xki = xk(ti), k = 1, ..., K, i = 1, ..., N, (2) где строки Многослойность сверточной НС определена необходимостью выделения из исходных данных достаточного количества признаков с разной степенью детализации для классификации заболеваний сердечно-сосудистой системы.
Основные операции, выполняемые при обучении предложенной НС, – свертка, объединение и классификация, которые реализуются в базисе последовательных сверточных слоев, слоев объединения и полносвязного слоя с функцией вероятностной классификации на выходе. Операция свертки на каждом i-м уровне использует два параметра: FNi – количество используемых фильтров и FSi – размер ядра свертки. В результате выполнения данной операции формируется i-й сверточный слой, включающий FNi матриц сформированных признаков. В каждом сверточном слое все матрицы имеют одинаковый размер, соответствующий размеру поступающих на его вход данных. За каждым сверточным слоем расположен слой активации на основе функции ELU (Exponential Linear Unit), которая позволяет использовать при обучении НС отрицательные значения входных данных. Операция объединения на каждом i-м уровне использует два параметра: PSi – размер окна объединения, Si – шаг перемещения. В результате выполнения данной операции формируется i-й слой объединения, включающий FNi матриц сформированных признаков меньшей размерности относительно размерности входных данных этого слоя: Ki = f1(Ki–1, FNi, FSi), Ni = f2(Ni–1, FNi, FSi), Ki ≤ Ki–1, Ni ≤ Ni–1. Полносвязный слой обеспечивает обработку признаков, сформированных в результате операций свертки и объединения на нескольких уровнях, с формированием классификационных признаков на выходе (yj, j = 1, ..., M), соот- ветствующих вероятности принадлежности входного ЭКГ-сигнала одной из M категорий. Реализация НА заболеваний сердечно-сосудистой системы
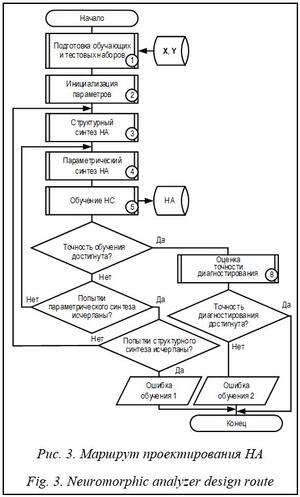
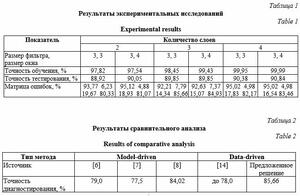
1. Подготовка обучающего и тестового входных наборов, представленных кортежами [Xtrn; Ytrn] и [Xtst; Ytst] соответственно, где Xtrn Ì X, Xtst Ì X, Xtst ∩ Xtst = Æ, X – множество ЭКГ-сигналов, Xtrn и Xtst – подмножества ЭКГ-сигналов, используемые для обучения и тестирования соответственно; Ytrn Ì Y, Ytst Ì Y, Y – множество идентификаторов заболеваний сердечно-сосудистой системы, выявленных по сигналам из X. 2. Инициализация параметров синтеза и ограничений: e – устанавливаемый относительный порог точности обучения НС; NStr_max и NPar_max – максимальное количество итераций при структурном и параметрическом синтезе НС соответственно; Ntrn_max – максимальное количество циклов обучения каждого экземпляра НС; NStr = 0 и NPar = 0 – фактическое количество попыток структурного и параметрического синтеза соответственно. 3. Структурный синтез НА, в ходе которого определены количество сверточных слоев (NCL) и тип используемых слоев объединения. 4. Параметрический синтез НА, в ходе которого назначены количество используемых фильтров (FNi) и их размерность (FSi) для каждого i-го сверточного слоя, размер окна объединения (PSi) и величина шага перемещения окна (Si) для каждого i-го слоя объединения. 5. Обучение НС входным набором [Xtrn; Ytrn], пока Acc > e и t < Ntrn_max, где Acc – оцененная относительная точность обучения на те- кущем шаге t. Математически процесс обучения сведен к решению оптимизационной задачи, в ходе которой выбирают параметры сети. В работе использован мини-пакетный адаптивный алгоритм оптимизации Adam, который применяет экспоненциальную скользящую среднюю первого и второго моментов градиента функции потерь и следующее правило обновления: gt = ÑQ J(Q), mt = b1 mt–1 + (1 – b1)gt, vt = = b2 vt–1 + (1 – b2)gt2, m_t = mt/(1 – bt1), v_t = vt/(1 – bt2), Qt+1 = Qt – am_t/sqrt (v_t + s), (3) где J(Q) – функция потерь (целевая функция); Q – параметры сети; a – скорость обучения; gt – градиент; mt и vt – первый и второй моменты градиента соответственно; s – сглаживающий параметр (исключает деление на 0). Мини-пакетный вариант реализации адаптивной оптимизации предполагает использование для расчета небольших пакетов обучающих данных размером NB, полученных при разбиении исходного набора [Xtrn; Ytrn]. Алго- ритм – мини-пакетная адаптивная оптимизация нейронной сети: Инициализация: 1: Q0; NB; e ¬ 0.001; t ¬ 0; s ¬ 10^(–8) 2: a ¬ 0.001; b1 ¬ 0.9; b2 ¬ 0.999 3: m0 ¬ 0; v0 ¬ 0 4: repeat 5: t ¬ t + 1 6: сформировать мини-пакет {(x(n)ki, y(n))}, n = 1..NB 7: gt ¬ Sn(ÑQ J({(x(n)ki, y(n))}, Qt–1)) 8: mt = b1 mt–1 + (1 – b1) gt 9: vt = b2 vt–1 + (1 – b2) gt2 10: m_t = mt /(1 – bt1) // коррекция mt при t = (1, 10) 11: v_t = vt /(1 – bt2) // коррекция vt при t = (1, 1000) 12: Qt = Qt–1 – a m_t / sqrt (v_t + s) 13: Acc = DQt 14: until and(Acc > e, t < Ntrn_max) return Qt 6. Если Acc > e, t = Ntrn_max и NPar < NPar_max, то NPar = NPar + 1 и необходимо перейти к шагу 4, выбрав новые значения для параметров FNi, FSi, PSi и Si, i = 1, ..., NCL. 7. Если Acc > e, и t = Ntrn_max, и NPar = NPar_max, и NStr < NStr_max, то NPar = 0, NStr = NStr + 1 и необходимо перейти к шагу 3, изменив количество сверточных слоев (NCL) и/или тип используемых слоев объединения. В противном случае формируется уведомление об ошибке обуче- ния 1 – «Невозможность обеспечить заданную точность обучения». 8. Если Acc ≤ e, то проводится оценка относительной точности диагностики заболеваний сердечно-сосудистой системы обученной НС на тестовых входных наборах [Xtst; Ytst]. Если точность диагностирования соответствует ожидаемой, то синтезированный НА можно использовать для диагностики заболеваний сердечно-сосудистой системы. Иначе формируется уведомление об ошибке обучения 2 – «Невозможность обеспечить заданную точность диагностирования (на используемых обучающих наборах [Xtrn; Ytrn])». Практическая часть Экспериментальные исследования предложенной архитектуры и маршрута проектирования НА заболеваний сердечно-сосудистой системы выполнены в пакете математических и инженерных расчетов MATLAB на компьютере с процессором Intel(R) Core(TM) i5-7500 3.40 GHz (х64), ОЗУ 32 Гб. В ходе исследования использованы наборы ЭКГ-сигналов PTB-XL [15] с известными медицинскими заключениями, которые включают 9 514 образцов, соответствующих норме (NORM), и 5 420 образцов, соответствующих инфаркту миокарда (MI), которые представлены 12-канальными ЭКГ (I, II, III, AVL, AVR, AVF, V1, ..., V6) длительностью 10 секунд (http://www.swsys.ru/ uploaded/image/2024-1/1. jpg). Входные коэффициенты для каждого канала – временной ряд длиной 1 000 отсчетов с 16-разрядной точностью. Соответственно, множество идентификаторов заболеваний сердечно-сосудистой системы образовано двумя видами ее состояний – Y = {NORM, MI}. Из исходного множества образцов X выделены подмножества ЭКГ-сиг- налов для формирования обучающих и тестовых наборов: ||Xtrn_NORM|| = 8 551, ||Xtst_NORM|| = 963, ||Xtrn_MI|| = 4 876, ||Xtst_MI|| = 544, Xtrn_NORM ∪ Xtrn_MI = Xtrn, Xtst_NORM ∪ Xtst_MI = Xtst, Xtrn ∩ Xtst = Æ. Выполнен структурный и параметрический синтез НА в соответствии с предложенной архитектурой. Количественные характеристики обучения НС и ее последующего тестирования представлены в таблице 1. Анализ результатов показывает, что НС с двумя сверточными слоями обладает низкой точностью обучения и высокими ошибками диагностирования. При увеличении числа сверточных слоев точность обучения возрастает до 99,99 %, а ошибки диагностирования снижаются. Важно отметить, что трехслойная НС способствует росту ошибок I рода, а четырехслойная – ошибок II рода.
Использование трехслойной сверточной НС с окном объединения меньшего размера позво- ляет диагностировать до 85,66 % случаев инфаркта миокарда, что количественно выражается в увеличении на 17 случаев, для которых НА корректно диагностировал инфаркт миокарда, – лучше на 3,65 % по сравнению с четырехслойной архитектурой. Для медицинской практики важно обеспечить максимальное выявление заболеваний сердечно-сосудистой системы (снижение ошибок II рода), что приводит к дополнительному анализу ЭКГ несколькими профильными специалистами и выработке экспертного заключения по нозологии. Ранняя качественная диагностика заболеваний сердечно-сосудистой системы и оперативно назначенное лечение снижают риск летального исхода пациента. Таблица 2 дает возможность сравнить результаты диагностирования инфаркта миокарда, полученные в данном иссле- довании и другими авторами с применением иных методов на основе искусственных НС.
Заключение Предложен подход к автоматизации построения нейроморфного анализатора, обеспечивающего выявление заболеваний сердечно-сосудистой системы с использованием одномерной многослойной сверточной НС и выполняю- щего непосредственный анализ ЭКГ-сигналов без предварительного выделения характерных признаков. Разработана настраиваемая архитектура НА ЭКГ-сигналов, обеспечивающая диагностику заболеваний на основе data-driven-метода. Предложен и апробирован маршрут проектирования НА заболеваний сердечно-сосудистой системы. Результаты экспериментальных исследований показали точность диагностики инфаркта миокарда до 85,66 %, что выше полученной с использованием model-driven-методов. Дальнейшие исследования планируется направить на поиск методов повышения точности диагностирования за счет снижения размерности входных ЭКГ-сигналов, а также введения вероятностной оценки принадлежности рассматриваемого сигнала одному из возможных состояний двойственной группы. Список литературы 1. Лобанов М.Г., Шоломов Д.Л. Об ускорении архитектуры сверточной нейронной сети на базе ResNet в задаче распознавания объектов дорожной сцены // Информационные технологии и вычислительные системы. 2019. № 3. С. 57–65. doi: 10.14357/20718632190305. 2. Kayumov Z., Tumakov D., Mosin S. Combined convolutional and perceptron neural networks for handwritten digits recognition. Proc. Int. Conf. DSPA, 2020, pp. 1–5. doi: 10.1109/DSPA48919.2020.9213301. 3. Mosin S. Machine learning and data mining methods in testing and diagnostics of analog and mixed-signal integrated circuits: Case study. In: CCIS. Proc. SIRS, 2019, vol. 968, pp. 240–255. doi: 10.1007/978-981-13-5758-9_21. 4. Гусев А.В., Гаврилов Д.В., Корсаков И.Н., Серова Л.М., Новицкий Р.Э., Кузнецова Т.Ю. Перспективы использования методов машинного обучения для предсказания сердечно-сосудистых заболеваний // Врач и информационные технологии. 2019. № 3. С. 41–47. 5. Мишкин И.А., Сахаров А.А. Изучение использования алгоритмов машинного обучения в оценке риска развития сердечно-сосудистых заболеваний // Инновации. Наука. Образование. 2020. № 17. С. 187–202. 6. Мустафаев А.Г. Использование нейросетевых методов для автоматического анализа электрокардиограмм при диагностике заболеваний сердечно-сосудистой системы // Кибернетика и программирование. 2019. № 1. С. 66–74. doi: 10.25136/2306-4196.2019.1.19343. 7. Пирова Д.Ф., Забержинский Б.Э., Машков А.В. Обнаружение признаков болезни сердца с использованием методов машинного обучения // ИТНТ: сб. тр. по мат. VI Междунар. конф. 2020. Т. 4. C. 736–740. 8. Катков П.И., Храмов А.Г. Исследование возможности использования искусственных нейронных сетей для диагностики инфаркта миокарда по электрокардиограмме // ИТНТ: сб. тр. по мат. VI Междунар. конф. 2019. Т. 4. C. 893–898. 9. Goovaerts G., Padhy S., Vandenberk B., Varon C. et al. A machine-learning approach for detection and quantification of QRS fragmentation. J-BHI, 2019, vol. 23, no. 5, pp. 1980–1989. doi: 10.1109/JBHI.2018.2878492. 10. Moskalenko V.A., Nikolskiy A.V., Zolotykh N.Yu., Kozlov A.A., Kosonogov K.A. et al. Cyberheart-diagnostics software package for automated electrocardiogram analysis based on machine learning techniques. Modern Technologies in Medicine, 2019, vol. 11, no. 2, pp. 86–91. doi: 10.17691/stm2019.11.2.12. 11. Бобков А.В., Аунг Х. Идентификация человека по видеоизображению в реальном времени на основе сетей YOLOv2 и VGG 16 // Автоматика и телемеханика. 2022. № 10. С. 94–104. doi: 10.31857/S0005231022100099. 12. Катермина Т.С., Сибагатулин А.Ф. Применение методов искусственного интеллекта к задаче диагностики заболеваний дыхательных путей // Computational Nanotechnology. 2022. Т. 9. № 2. С. 92–103. doi: 10.33693/2313-223X-2022-9-2-92-103. 13. Сорокина В.В., Абламейко С.В. Выделение отдельных участков тела человека на изображении с использованием нейронных сетей и модели внимания // Журнал БГУ. Математика. Информатика. 2022. № 2. С. 94–106. doi: 10.33581/2520-6508-2022-2-94-106. 14. Gumpfer N., Grün D., Hannig J., Keller T., Guckert M. Detecting myocardial scar using electrocardiogram data and deep neural networks. Biological Chemistry, 2021, vol. 402, no. 8, pp. 911–923. doi: 10.1515/hsz-2020-0169. 15. Wagner P., Strodthoff N., Bousseljot R., Samek W., Schaeffter T. PTB-XL, a large publicly available electrocardiography dataset (version 1.0.3). PhysioNet, 2022. URL: https://physionet.org/content/ptb-xl/1.0.3/ (дата обращения: 02.09.2023). References 1. Lobanov, M.G., Sholomov, D.L. (2019) ‘On the acceleration of the convolutional neural network architecture based on resnet in the task of road scene objects recognition’, JITCS, (3), pp. 57–65 (in Russ.). doi: 10.14357/20718632190305. 2. Kayumov, Z., Tumakov, D., Mosin, S. (2020) ‘Combined convolutional and perceptron neural networks for handwritten digits recognition’, Proc. Int. Conf. DSPA, pp. 1–5. doi: 10.1109/DSPA48919.2020.9213301. 3. Mosin, S. (2019) ‘Machine learning and data mining methods in testing and diagnostics of analog and mixed-signal integrated circuits: Case study’, in CCIS. Proc. SIRS, 968, pp. 240–255. doi: 10.1007/978-981-13-5758-9_21. 4. Gusev, A.V., Gavrilov, D.V., Korsakov, I.N., Serova, L.M., Novitsky, R.E., Kuznetsova, T.Yu. (2019) ‘Prospects for the use of machine learning methods for predicting cardiovascular disease’, Medical Doctor and Inform. Tech., (3), pp. 41–47 (in Russ.). 5. Mishkin, I.A., Sakharov, A.A. (2020) ‘Studying the use of machine learning algorithms in assessing the risk of developing cardiovascular diseases’, Innovation. Sci. Education, (17), pp. 187–202 (in Russ.). 6. Mustafaev, A.G. (2019) ‘Neural network techniques for automatic electrocardiogram analysis in the diagnosis of diseases of the cardiovascular system’, Cybernetics and Programming, (1), pp. 66–74 (in Russ.). doi: 10.25136/2306-4196.2019.1.19343. 7. Pirova, D.F., Zaberzhinskiy, B.E., Mashkov, A.V. (2020) ‘Detecting heart disease symptoms using machine learning’, Proc. ITNT, 4, pp. 736–740 (in Russ.). 8. Katkov, P.I., Khramov, A.G. (2019) ‘The study of the possibility of using artificial neural networks for the diagnosis of myocardial infarction by electrocardiogram’, Proc. ITNT, 4, pp. 893–898 (in Russ.). 9. Goovaerts, G., Padhy, S., Vandenberk, B., Varon, C. et al. (2019) ‘A machine-learning approach for detection and quantification of QRS fragmentation’, J-BHI, 23(5), pp. 1980–1989. doi: 10.1109/JBHI.2018.2878492. 10. Moskalenko, V.A., Nikolskiy, A.V., Zolotykh, N.Yu., Kozlov, A.A., Kosonogov, K.A. et al. (2019) ‘Cyberheart-diagnostics software package for automated electrocardiogram analysis based on machine learning techniques’, Modern Technologies in Medicine, 11(2), pp. 86–91. doi: 10.17691/stm2019.11.2.12. 11. Bobkov, A.V., Aung, H. (2022) ‘Identification of a person from a video image in real time based on the YOLOv2 and VGG-16 networks’, Automation and Remote Control, (10), pp. 1567–1575 (in Russ.). doi: 10.31857/ 12. Katermina, T.S., Sibagatulin, A.F. (2022) ‘Application of artificial intelligence methods to the task of diagnosing respiratory diseases’, Computational Nanotechnology, 9(2), pp. 92–103 (in Russ.). doi: 10.33693/2313-223X-2022-9-2-92-103. 13. Sorokina, V.V., Ablameyko, S.V. (2022) ‘Detection of human body parts on the image using the neural networks and the attention model’, J. of the BSU. Math. and Inform., (2), pp. 94–106 (in Russ.). doi: 10.33581/2520-6508-2022-2-94-106. 14. Gumpfer, N., Grün, D., Hannig, J., Keller, T., Guckert, M. (2021) ‘Detecting myocardial scar using electrocardiogram data and deep neural networks’, Biological Chemistry, 402(8), pp. 911–923. doi: 10.1515/hsz-2020-0169. 15. Wagner, P., Strodthoff, N., Bousseljot, R., Samek, W., Schaeffter, T. (2022) ‘PTB-XL, a large publicly available electrocardiography dataset (version 1.0.3)’, PhysioNet, available at: https://physionet.org/content/ptb-xl/1.0.3/ (accessed September 02, 2023). |
| Постоянный адрес статьи: http://swsys.ru/index.php?page=article&id=5063&lang= |
Версия для печати |
| Статья опубликована в выпуске журнала № 1 за 2024 год. [ на стр. 122-130 ] |
Возможно, Вас заинтересуют следующие статьи схожих тематик: